 За останніми оцінками ВООЗ 64 млн людей у світі страждають на хронічне обструктивне захворювання легень (ХОЗЛ), а 3 млн уже померли від нього. Більше того, за прогнозами цієї організації, до 2030 року ХОЗЛ стане третьою за значущістю причиною смерті у світі. Отже, основними завданнями, що стоять перед лікарем, є адекватний вплив на симптоми цієї тяжкої хвороби і запобігання розвитку її загострень.
За останніми оцінками ВООЗ 64 млн людей у світі страждають на хронічне обструктивне захворювання легень (ХОЗЛ), а 3 млн уже померли від нього. Більше того, за прогнозами цієї організації, до 2030 року ХОЗЛ стане третьою за значущістю причиною смерті у світі. Отже, основними завданнями, що стоять перед лікарем, є адекватний вплив на симптоми цієї тяжкої хвороби і запобігання розвитку її загострень.
Відповідно до останніх декларативних документів, присвячених ХОЗЛ, першочерговими завданнями терапії є зниження інтенсивності симптомів та ризику прогресування хвороби. Згідно із Global Initiative for Chronic Obstructive Pulmonary Disease (GOLD 2016) особливу увагу слід приділяти зменшенню вираженості клінічної симптоматики та підвищенню якості життя (ЯЖ) хворого за мінімальних побічних ефектів лікування. Дійсно, найчастішим приводом для першого звернення пацієнта з імовірним діагнозом ХОЗЛ до лікаря-терапевта є поява нових скарг або посилення «знайомих» симптомів. Наприклад, посилення виділення мокротиння, поява гнійного мокротиння, збільшення задишки, що нерідко супроводжується підвищенням температури тіла. При цьому в пацієнтів із клінічними проявами, котрі з’являються незалежно від часу доби, гірший прогноз і нижча ЯЖ (погане загальне самопочуття, депресія, тривожність, розлади сну).
Контроль симптомів захворювання допомагає краще оцінити стан пацієнта, відповідь на лікування, забезпечити профілактику загострень, сповільнити прогресування і досягти контролю ХОЗЛ. Про значення клінічних проявів ХОЗЛ свідчать порівняльні дослідження, присвячені оцінці виживаності хворих із ХОЗЛ відповідно до підгруп 1-4 (по GOLD 2007) і A-D (по GOLD 2011). Отже, у групі B виживаність гірша, ніж у групі C, тобто у хворих із вираженими симптомами, незважаючи на задовільні показники обсягу форсованого видиху за 1-у секунду (ОФВ1; ≥50% від належної величини), порівняно із пацієнтами з невираженими симптомами, але з низькими показниками ОФВ1 (<50% від належної величини).
Чи можливий контроль при ХОЗЛ?
 Поняття «контролю» включає підтримку стану пацієнта з мінімальним впливом захворювання на повсякденну активність (беручи до уваги тяжкість перебігу ХОЗЛ). Оптимальний контроль ХОЗЛ може бути визначений такими критеріями:
Поняття «контролю» включає підтримку стану пацієнта з мінімальним впливом захворювання на повсякденну активність (беручи до уваги тяжкість перебігу ХОЗЛ). Оптимальний контроль ХОЗЛ може бути визначений такими критеріями:
- мінімальний вплив ХОЗЛ на людину відповідно до початкової тяжкості хвороби (симптоми не виражені);
- стабільність стану, тобто відсутність значущого клінічного погіршення та відсутність загострень протягом принаймні останніх 3 місяців.
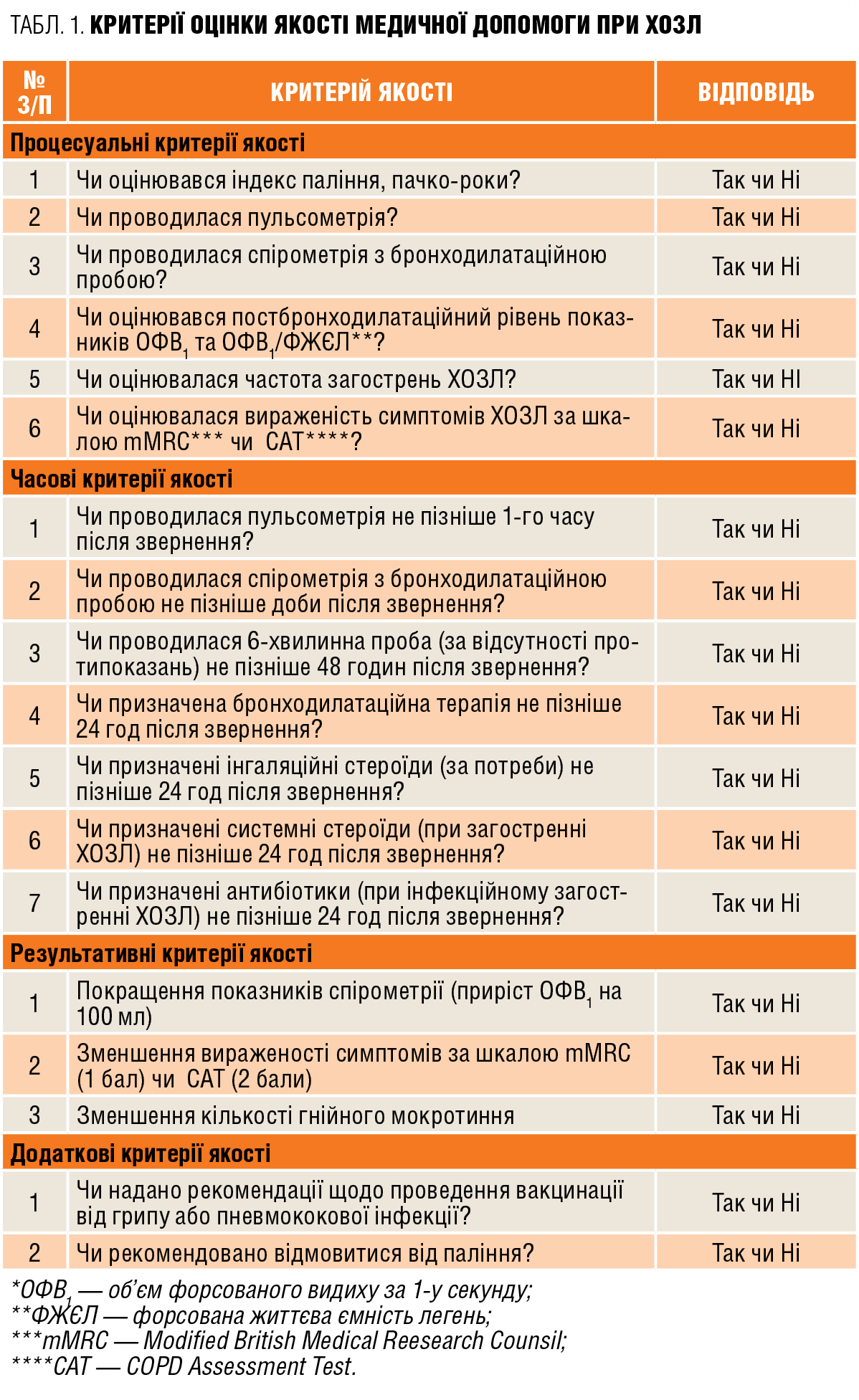
Досягнення контролю над захворюванням залежить від дотримання критеріїв якості надання медичної допомоги пацієнту із ХОЗЛ, що відображають анамнестичні відомості, симптоми хвороби, функціональні показники, своєчасність і адекватність лікувальних заходів за стабільного перебігу захворювання і при загостренні (табл. 1).
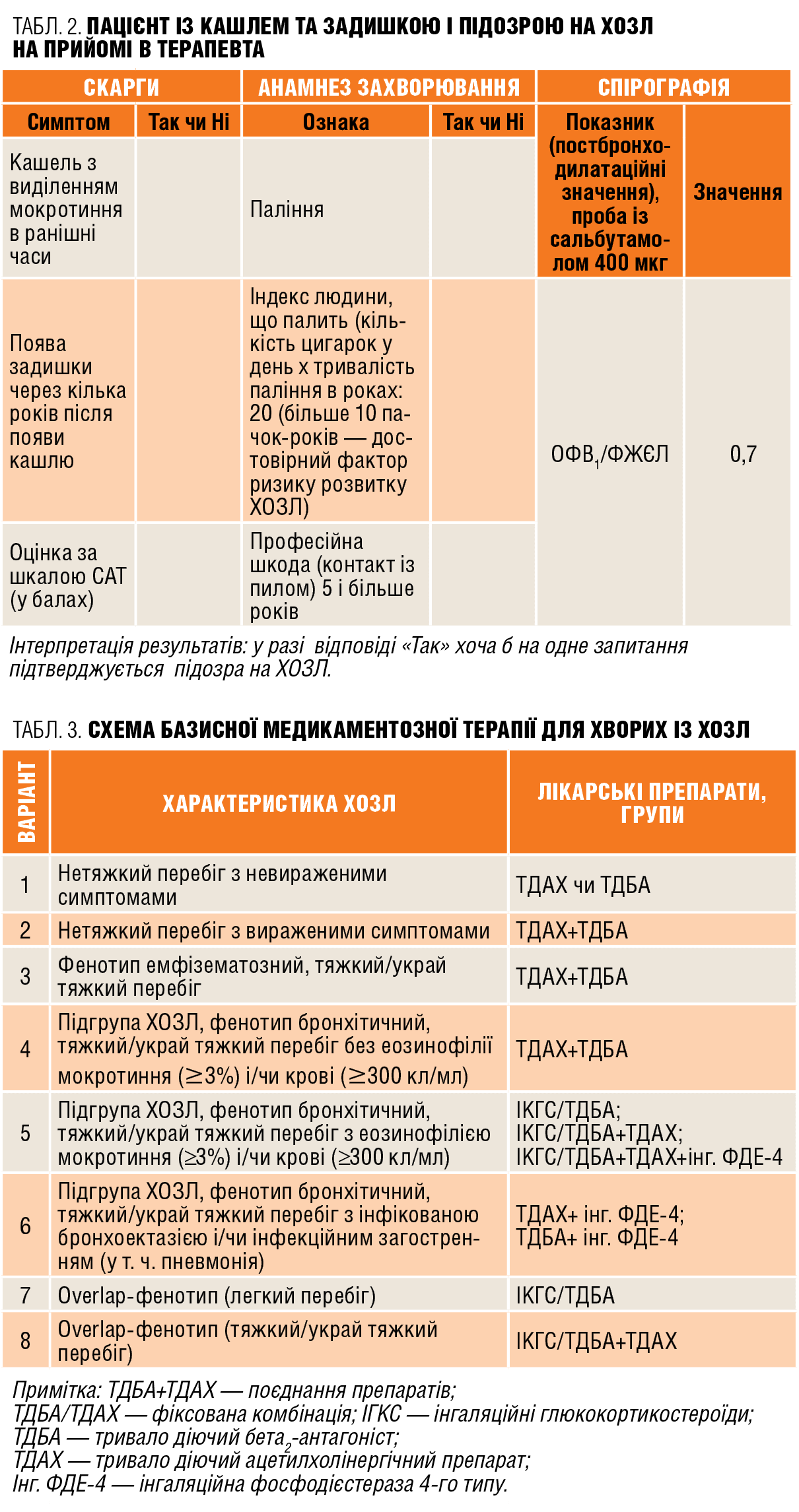
Актуальним питанням є рання діагностика ХОЗЛ і призначення своєчасної адекватної стартової терапії. За даними Європейського респіраторного товариства, тільки 25% випадків захворювання діагностують своєчасно! Для допомоги лікарю первинної ланки (терапевту, сімейному лікарю) створено алгоритм ранньої діагностики ХОЗЛ (табл. 2), розроблено показання і визначено необхідний обсяг досліджень для направлення на консультацію до пульмонолога.
Показаннями до направлення до пульмонолога є:
- підозра на ХОЗЛ або вперше діагностована хвороба;
- диференційна діагностика ХОЗЛ;
- відсутність ефекту від лікування або виникнення побічних проявів призначеної лікарської терапії.
Перед консультацією необхідно пройти такі дослідження:
- аналіз крові з лейкоцитарною формулою;
- визначення ОФВ1 й інгаляційний бронхолітичний тест із сальбутамолом 400 мкг (поза загостренням захворювання);
- рентгенографію органів грудної клітки у двох проекціях;
- комп’ютерну томографію (КТ) органів грудної клітки (за можливості);
- електрокардіографію;
- ехокардіографію (за потреби).
Нюанси лікування
 Відповідно до GOLD усім пацієнтам незалежно від тяжкості захворювання рекомендовані нефармакологічні методи впливу і медикаментозна терапія. Слід зазначити, що нефармакологічні методи впливу є невід’ємною і дуже важливою складовою лікування ХОЗЛ, профілактики загострень і прогресування захворювання.
Відповідно до GOLD усім пацієнтам незалежно від тяжкості захворювання рекомендовані нефармакологічні методи впливу і медикаментозна терапія. Слід зазначити, що нефармакологічні методи впливу є невід’ємною і дуже важливою складовою лікування ХОЗЛ, профілактики загострень і прогресування захворювання.
Куріння — безумовний фактор розвитку ХОЗЛ і його швидшого прогресування. Серед механізмів зниження показників функції зовнішнього дихання у курців розглядається дефіцит вітаміну D, який справляє імуномодулювальний та протизапальний ефекти, котрі пригнічуються під впливом тютюнового диму. У 20-річному дослідженні продемонстровано, що функція легень в осіб, які палять, на тлі дефіциту вітаміну D знижується швидше, ніж в осіб із нормальним рівнем цього вітаміну. В іншому дослідженні показано високе поширення дефіциту вітаміну D — 66% у популяції курців, які страждають на ХОЗЛ. Відмова від куріння сприяє уповільненню зниженню ОФВ1 майже в 2 рази порівняно з тими пацієнтами, які продовжують палити. Це було встановлено в 5-річному дослідженні здоров’я легень у 5887 хворих із ХОЗЛ легкого та середнього ступеня тяжкості (Lung Health Study — LHS). Відмова від куріння — єдиний захід, що запобігає прогресуванню емфіземи і сприяє зменшенню вираженості респіраторних симптомів.
Окрім цього, кожному пацієнту із ХОЗЛ має бути запропонована вакцинація проти грипу і пневмококової інфекції. Вакцинопрофілактика ефективніша в осіб похилого віку та із тяжким перебігом захворювання або супутньою серцевою патологією, оскільки саме в цієї категорії хворих із ХОЗЛ реєструється найвища ймовірність розвитку загострень основного захворювання або тяжкої супутньої патології.
На жаль, практикуючі лікарі приділяють недостатньо уваги легеневій реабілітації, що включає окрім фізичних тренувань освітні та психосоціальні програми, створені для поліпшення фізичного й емоційного стану хворих і забезпечення тривалої прихильності пацієнта до поведінки, спрямованої на збереження здоров’я.
У рекомендаціях GOLD наведено широкий спектр лікарських засобів. Вони об’єднані в 4 групи (А, В, С, D) відповідно до тяжкості ХОЗЛ, вираженості симптомів і частоти загострень. Кожна група включає кілька найменувань препаратів і їх поєднань.
Нині бронходилататори тривалої дії з високим рівнем ефективності та безпечності є основними лікарськими препаратами (1-ї лінії) базисної (регулярної) терапії хворих із ХОЗЛ. Їх призначають усім пацієнтам із ХОЗЛ, незалежно від тяжкості захворювання. Доведено, що подвійна бронходилатація (тривалої дії антихолінергічні (ТДАХ) препарати і тривалої дії бета2-антагоністи (ТДБА) є ефективнішою порівняно з монотерапією кожним із цих препаратів за виражених симптомів і пріоритетнішою для стартової терапії ХОЗЛ. У нещодавно опублікованому рішенні ради експертів респіраторного товариства про доцільність застосування фіксованих комбінацій ТДАХ і ТДБА у фармакотерапії ХОЗЛ зазначається їх важлива роль у впливі на редукцію симптомів, поліпшення легеневої функції, переносимість фізичного навантаження і ЯЖ, а також у запобіганні загостренням.
Інгаляційні глюкокортикостероїди (ІГКС) у комбінації із ТДБА або у складі «потрійної» комбінації з ТДАХ рекомендуються для тривалого лікування ХОЗЛ за наявності частих загострень в анамнезі. Водночас дані про вплив ІГКС на смертність обмежені та суперечливі. Крім того, комбінована терапія (ІГКС + ТДБА) підвищує ризик розвитку пневмонії, у зв’язку із чим перед вирішенням питання, додавати ІГКС до схеми лікування ХОЗЛ чи ні, потрібно ретельно оцінити клінічну картину.
Інгібітори фосфодіестерази 4-го типу (ФДЕ-4) у комбінації із ТДАХ або у складі «потрійної» комбінації із ІГКС/ТДБА, згідно з рекомендаціями GOLD, показані хворим із ХОЗЛ груп С і D. У дослідженні REACT з вивчення ефективності комбінації (ІГКС/ТДБА) + ТДАХ + ФДЕ-4 встановлено достовірне зниження ризику тяжких загострень, що призводять до госпіталізації. Формально згідно з рекомендаціями GOLD інгібітори ФДЕ-4, як і ІГКС, можуть бути призначені хворим із частими загостреннями. Тоді як доведено і досить добре відомо, що інгібітори ФДЕ-4 знижують частоту середніх та тяжких загострень у пацієнтів із бронхітичним варіантом ХОЗЛ тяжкого і вкрай тяжкого перебігу й загостреннями в анамнезі (А, 1++).
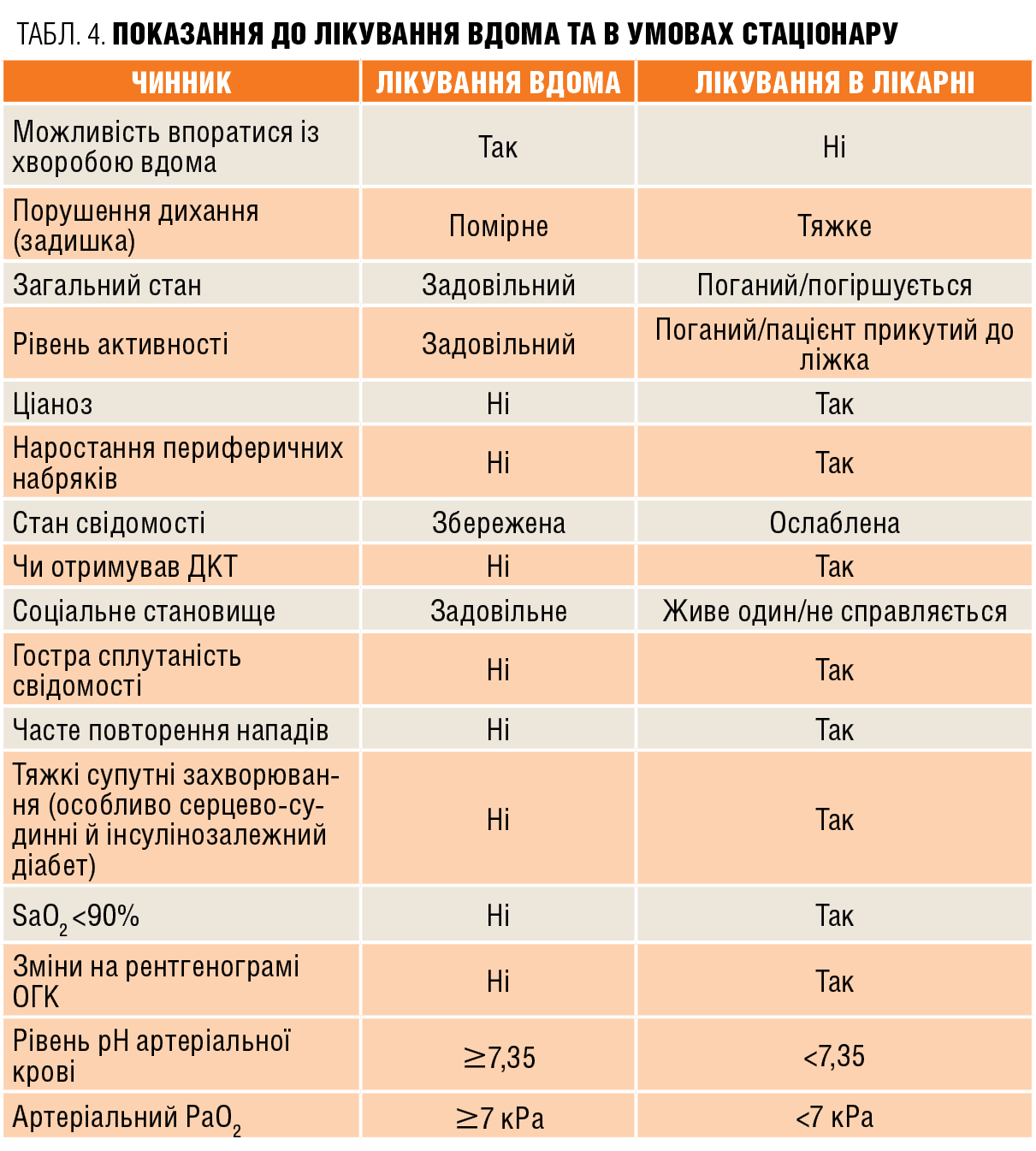
Одним з основних питань лікування хворих із ХОЗЛ є визначення обсягу стартової та подальшої терапії. На жаль, розподіл хворих відповідно до сучасної класифікації GOLD на 4 групи (A, B, C, D) не дає на нього конкретної відповіді. Незважаючи на те що вибір лікарської терапії на підставі класифікації GOLD залежить від вираженості симптомів, ступеня обмеження повітряного потоку і ризику загострень, перед лікарем постає непросте завдання конкретного вибору тієї чи іншої схеми для конкретного хворого (табл. 3, 4).
Лікування за фенотипами
 Для оптимізації базисної терапії ХОЗЛ і вирішення питання про призначення ІГКС або інгібіторів ФДЕ-4 доцільно розглядати відомі фенотипи (бронхітичний, емфізематозний, оverlap-фенотип — поєднання ХОЗЛ і бронхіальної астми (БА)) з точки зору особливостей клітинного характеру запалення, а також з урахуванням методів променевої діагностики (комп’ютерно-томографічна фенотипічна характеристика), анамнестичних відомостей про характер загострень (інфекційна, неінфекційна пневмонії в анамнезі). Перенесені в минулому пневмонії у хворих на ХОЗЛ розцінюються як протипоказання до призначення ІГКС, хоча механізм пневмонії у таких пацієнтів на тлі лікування зазначеними препаратами остаточно не з’ясований. Розглядаючи причини розвитку пневмонії при застосуванні ІГКС, слід враховувати, що різні ІГКС проявляють різну імуносупресивну активність (наприклад, імуносупресивна активність флютиказону пропіонату в 10 разів вища, ніж у будесоніду). Своєю чергою, КТ-фенотипічна характеристика допомагає зрозуміти клінічне розмаїття ХОЗЛ. Наприклад, КТ високої роздільної здатності дало змогу виявити бронхоектазію у 33,8% хворих із ХОЗЛ III-IV за GOLD. У зв’язку із цим наявність саме інфікованих бронхоектазів, а не тільки бронхоектазів у таких пацієнтів слід розглядати як фактор ризику інфекційного загострення на тлі лікування ІГКС.
Для оптимізації базисної терапії ХОЗЛ і вирішення питання про призначення ІГКС або інгібіторів ФДЕ-4 доцільно розглядати відомі фенотипи (бронхітичний, емфізематозний, оverlap-фенотип — поєднання ХОЗЛ і бронхіальної астми (БА)) з точки зору особливостей клітинного характеру запалення, а також з урахуванням методів променевої діагностики (комп’ютерно-томографічна фенотипічна характеристика), анамнестичних відомостей про характер загострень (інфекційна, неінфекційна пневмонії в анамнезі). Перенесені в минулому пневмонії у хворих на ХОЗЛ розцінюються як протипоказання до призначення ІГКС, хоча механізм пневмонії у таких пацієнтів на тлі лікування зазначеними препаратами остаточно не з’ясований. Розглядаючи причини розвитку пневмонії при застосуванні ІГКС, слід враховувати, що різні ІГКС проявляють різну імуносупресивну активність (наприклад, імуносупресивна активність флютиказону пропіонату в 10 разів вища, ніж у будесоніду). Своєю чергою, КТ-фенотипічна характеристика допомагає зрозуміти клінічне розмаїття ХОЗЛ. Наприклад, КТ високої роздільної здатності дало змогу виявити бронхоектазію у 33,8% хворих із ХОЗЛ III-IV за GOLD. У зв’язку із цим наявність саме інфікованих бронхоектазів, а не тільки бронхоектазів у таких пацієнтів слід розглядати як фактор ризику інфекційного загострення на тлі лікування ІГКС.
На сьогодні достатньо підстав для включення ІГКС + ТДБА у схему терапії ХОЗЛ з урахуванням рівня еозинофілів в аналізах мокротиння, периферичної крові або рівня FeNO. Потенційними маркерами призначення ІГКС у поєднанні з ТДБА є число еозинофілів у мокротинні ≥3%, у периферичній крові ≥300 кл/мл або збільшення показників FeNO≥25 ppb.
Отже, вирішуючи питання включення ІГКС у схему терапії ХОЗЛ у хворих із частими загостреннями рекомендується зважувати ризик і користь від їх призначення, виділяти окремі групи/підгрупи пацієнтів з урахуванням даних КТ високої роздільної здатності, клітинного характеру запалення, анамнестичних відомостей на підставі медичної документації про характер загострень (інфекційні, неінфекційні). Ці підходи варто передусім застосовувати до хворих із бронхітичним фенотипом ХОЗЛ. Виділення різних варіантів бронхітичного фенотипу (підгруп) допоможуть лікарю вибрати оптимальний варіант медикаментозної терапії.
Щодо емфізематозного фенотипу ХОЗЛ, то для цієї категорії пацієнтів препаратами вибору є ТДБА, а в разі термінального перебігу показані хірургічна редукція легеневих обсягів, тривала киснева терапія на дому, трансплантація легень. Доказів доцільності призначення ІГКС або інгібіторів ФДЕ-4 пацієнтам з емфізематозним фенотипом досі не отримано.
Підготувала Тетяна ПРИХОДЬКО, «ВЗ», за матеріалами rmj.ru











