Фармацевтичні компанії Pfizer та Moderna планують розширити дослідження вакцини проти коронавірусу серед дітей віком від п’яти до одинадцяти років. Початкова вибірка дослідження була недостатньою для виявлення рідкісних побічних ефектів. Про це повідомляє видання ABC News.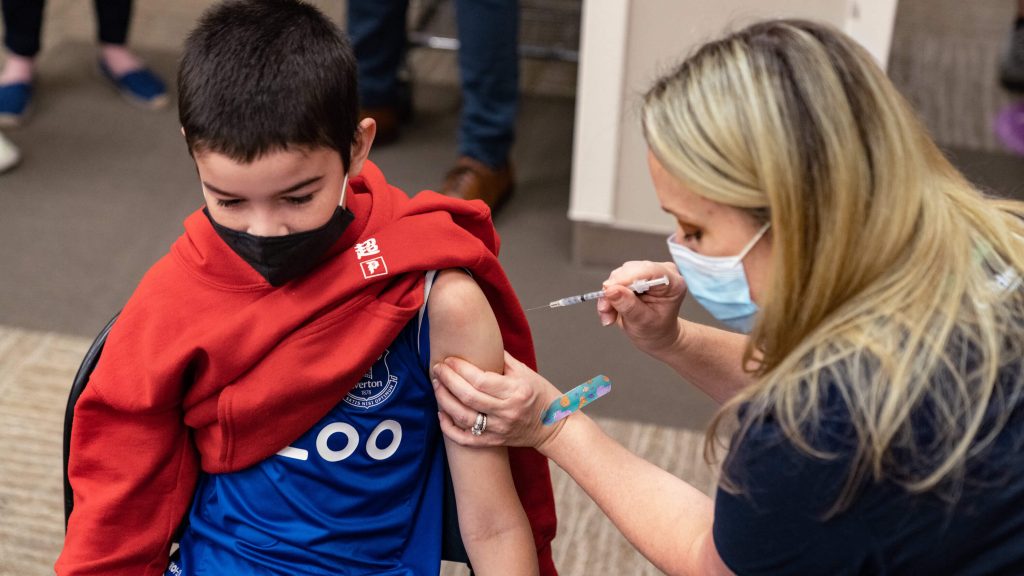 Відповідне рішення прийняли, коли у FDA заявили про необхідність аналізу побічних ефектів після щеплення у молодих людей до 30 років. За інформацією The New York Times, дослідження має бути спрямоване на виявлення рідкісних побічних ефектів, таких як міокардит і перикардит.
Відповідне рішення прийняли, коли у FDA заявили про необхідність аналізу побічних ефектів після щеплення у молодих людей до 30 років. За інформацією The New York Times, дослідження має бути спрямоване на виявлення рідкісних побічних ефектів, таких як міокардит і перикардит.
Повідомляється, що у компанії Pfizer відмовилися коментувати повідомлення видання та вказали на графік вакцинації, який опублікували раніше. У фармкомпанії зазначили, що випробування серед дітей у віці від п’яти до одинадцяти років почалося на початку червня, а серед дітей до п’яти років – 21 червня. У компанії очікують, що результати першого та другого етапу дослідження препарату в групі дітей від п’яти до одинадцяти років будуть доступні у вересні.
«Ми маємо намір розширити дослідження, і ми активно обговорюємо пропозицію з FDA», – заявили у фармацевтичній компанії Moderna.
Поки що невідомо, яким чином такі зміни можуть вплинути на термін видачі дозволу від FDA на екстрене використання вакцини від коронавірусу для дітей.
«Мета полягає в тому, щоб зареєструвати більшу базу даних з безпеки, яка збільшує ймовірність виявлення рідкісних реакцій. Терміни регулярно переглядаються на основі обговорень і запитів регулятора», – роз’яснили у Moderna.
Повідомляється, що Moderna розраховує отримати дозвіл на використання власної вакцини проти коронавірусу у надзвичайних ситуаціях до кінця 2021 року або на початку 2022 року.
FDA відмовляється коментувати обговорення цього питання з Pfizer і Moderna, але підтвердила участь агентства у прийнятті рішення про те, скільки учасників необхідно для безпечних клінічних випробувань.
«Хоча ми не можемо коментувати індивідуальні взаємодії зі спонсорами, ми, як правило, працюємо зі спонсорами, щоб забезпечити достатній розмір учасників клінічних випробувань для виявлення сигналів безпеки», – йдеться в заяві агентства.
Минулого тижня у заяві регулятора зазначалося, що деякі члени консультативного комітету хотіли б бачити більш тривалий середній час спостереження після вакцинації, який наразі складає два місяці. У регуляторі додали, що для дослідження вакцини у молодшій віковій групі агентство має намір взяти до уваги рекомендації консультативних комітетів.
Слід зазначити, що у ВООЗ заявили про необхідність додаткових доказів використання вакцин проти COVID-19 у дітей.
Нагадаємо, що в Україні лише 33% батьків готові підтримати запровадження імунізації проти вірусу SARS-CoV-2 дітей віком 12-17 років.











